टिप 1: रासायनिक संरचना क्या है
टिप 1: रासायनिक संरचना क्या है
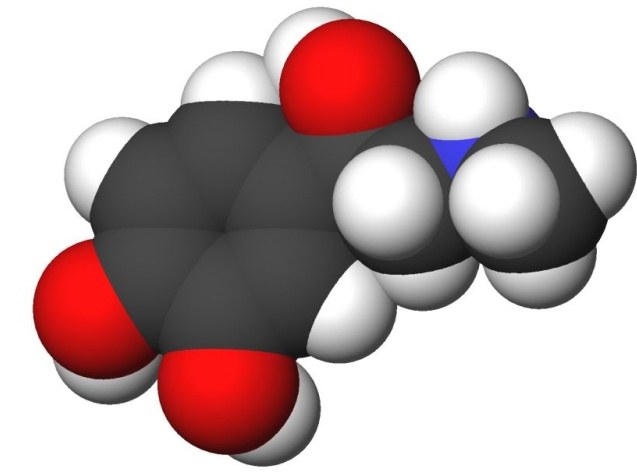
रासायनिक संरचना का सिद्धांत एक सिद्धांत है जोउस क्रम का वर्णन करता है जिसमें परमाणु कार्बनिक पदार्थों के अणुओं में व्यवस्थित होते हैं, परमाणुओं पर परस्पर परस्पर प्रभाव पड़ता है, और पदार्थ के रासायनिक और भौतिक गुणों को इस क्रम और पारस्परिक प्रभाव से बाहर निकलता है।
टिप 2: अपेक्षाकृत प्रमुख संख्याएं क्या हैं?
उत्परिवर्तनीय प्रधान संख्याएं एक गणितीय अवधारणा हैं, जिनके साथ संख्याओं को सरल नहीं समझना चाहिए। दोनों अवधारणाओं के बीच आम है कि वे दोनों का विभाजन के साथ सीधा संबंध है।

गणित में सरल को एक संख्या कहा जाता है,जो केवल एक करके और स्वयं में विभाजित किया जा सकता है। 3, 7, 11, 143 और 1 111 111 सभी प्रमुख संख्याएं हैं, जिनमें से प्रत्येक की अलग-अलग संपत्ति है। पारस्परिक रूप से प्रधान संख्याओं के बारे में बात करने के लिए उनमें से कम से कम दो का होना चाहिए। यह अवधारणा कई संख्याओं की आम विशेषता को दर्शाती है।
अपेक्षाकृत प्रमुख संख्याओं की परिभाषा
उत्परिवर्तनीय सरल उन संख्याएं हैं जोउदाहरण के लिए, 3 और 5 की गणना नहीं करने वाले एक सामान्य विभाजक नहीं हैं। इस मामले में, प्रत्येक संख्या अलग-अलग रूप से अपने आप में सरल नहीं हो सकती.उदाहरण के लिए, संख्या 8 को लागू नहीं होता है, क्योंकि इसे 2 और 4 में विभाजित किया जा सकता है, लेकिन 8 और 11 अपेक्षाकृत प्रमुख संख्या हैं। यहाँ परिभाषित विशेषता एक सामान्य विभाजक की अनुपस्थिति है, न कि व्यक्तिगत संख्याओं की विशेषताएँ। हालांकि, दो या दो से अधिक मूल संख्या हमेशा परस्पर प्राइम होंगे। अगर उनमें से प्रत्येक को केवल एक में ही विभाजित किया गया है, तो एक आम विभाजक नहीं हो सकता है। पारस्परिक रूप से प्रधान संख्याओं के लिए एक क्षैतिज खंड के रूप में एक विशेष अंकन है और उस पर एक सीधा गिरा दिया गया है। यह सीधा सीधा रेखाओं की संपत्ति के साथ संबद्ध होता है, जिनके पास सामान्य दिशा नहीं होती है, क्योंकि ये संख्याएं एक आम विभाजक नहीं हैं।पारस्परिक रूप से मूल संख्या
शायद अपेक्षाकृत प्रमुख संख्याओं का संयोजन,जिसमें से आप बेतरतीब ढंग से किसी भी दो नंबर ले सकते हैं, और वे आवश्यक रूप से पारस्परिक रूप से सरल होंगे। उदाहरण के लिए, 2, 3 और 5: आम भाजक में न तो 2 और 3, न 2 और 5, न 5 और 3 है। इस तरह के नंबरों को जोड़ीदार अपेक्षाकृत प्रधानमंत्री कहा जाता है। उदाहरण के लिए, 15, 20 और 21 संख्याएं पारस्परिक रूप से प्रमुख संख्या हैं, लेकिन उन्हें जोड़ीदार अपेक्षाकृत प्रमुख नहीं कहा जा सकता है, क्योंकि 15 और 20 को 5 से विभाजित किया जाता है, और 15 और 21 को 3 से विभाजित किया जाता है।पारस्परिक रूप से प्रमुख संख्याओं का उपयोग
श्रृंखला हस्तांतरण में, एक नियम के रूप में, मात्राचेन लिंक्स और sprocket दांत को परस्पर प्रधानमंत्री संख्याओं द्वारा व्यक्त किया जाता है। इस वजह से, दांतों में से प्रत्येक चेन की एक कड़ी को बदले में छूता है, तंत्र कम पहनते हैं। परस्पर प्रधान संख्याओं की एक और अधिक दिलचस्प संपत्ति भी है। एक आयताकार बनाना आवश्यक है जिसका लंबाई और चौड़ाई परस्पर प्रधानमंत्री संख्याओं द्वारा व्यक्त की जाती है, और 45 डिग्री के कोण पर आयत के अंदर के कोण से एक किरण खींचती है। आयत के किनारे के साथ किरण के संपर्क के बिंदु पर, एक और रे, जो पहले एक से 90 डिग्री के कोण पर स्थित है, तैयार किया जाना है। समय के बाद प्रतिबिंब के समय के ऐसे किरणों को बनाने से, आप एक ज्यामितीय पैटर्न प्राप्त कर सकते हैं जिसमें संरचना का कोई भी भाग पूरे जैसा है। गणित के दृष्टिकोण से, यह पैटर्न भग्न है।टिप 3: मानव पाचन तंत्र क्या है
एक व्यक्ति को रहने की जरूरत हैपोषक तत्व: प्रोटीन, एमिनो एसिड, मोनोसैक्राइड और जैसे। यह सब भोजन में है, लेकिन एक जटिल, कम-पाचनशील रूप में कोशिकाओं को आवश्यक पदार्थ प्राप्त करने के लिए, भोजन को विभाजित किया जाना चाहिए। यह कार्य पाचन तंत्र द्वारा किया जाता है प्रणाली.

टिप 4: अक्रिय गैस क्या है
आवधिक तालिका में जड़ गैसों तत्व हैंसमूह आठवीं का मुख्य उप समूह: हीलियम, नीयन, आर्गन, क्रिप्टन, क्सीनन और राडोण, बाद वाला रेडियोधर्मी तत्व है उन्हें महान गैस भी कहा जाता है

निष्क्रिय गैसों की इलेक्ट्रॉनिक संरचना
सभी निष्क्रिय गैसों में एक पूर्ण, स्थिर हैबाहरी इलेक्ट्रॉनिक स्तर का विन्यास: हीलियम एक डबल है, शेष गैसों में एक ओकटेट है उनमें से प्रत्येक आवधिक तालिका में इसी अवधि को पूरा करता है।प्रकृति में जड़ गैसों
रेडियोधर्मी रेडोन को छोड़कर सभी जड़ गैस,वायुमंडलीय हवा में पाया जा सकता है हीलियम हाइड्रोजन के बाद अंतरिक्ष में सबसे आम तत्व है। पॉजिट्रोन्स और एंटिनेट्रीनो की रिहाई के साथ परमाणु संलयन की प्रतिक्रिया से हाइड्रोजन से बनने वाले इस महान गैस से सूरज 10% है।महान गैसों के भौतिक गुण
निष्क्रिय गैसों monatomic द्वारा प्रतिनिधित्व कर रहे हैंअणुओं। सामान्य परिस्थितियों में, हीलियम, नीयन, आर्गन, क्रिप्टन और क्सीनन - बिना रंग और गंध के गैसों, पानी में खराब घुलनशील। उनके परमाणु संख्या जितनी अधिक होती है, उबलते बिंदु और पिघलने बिंदु अधिक होता है। हीलियम में अद्वितीय गुण होते हैं: यह सबसे कम तापमान पर भी तरल रहता है, शून्य से नीचे, क्रिस्टलीकरण के दौर से गुजर बिना। हीलियम के क्रिस्टलीकरण केवल 25 वायुमंडल के दबाव में संभव है। इसके अलावा, इस गैस में सभी पदार्थों का सबसे कम उबलते बिंदु है।महान गैसों के रासायनिक गुण
एक लंबे समय के लिए यह माना जाता था कि सामान्य रूप से जड़ गैसोंकनेक्शन का निर्माण न करें हालांकि, प्रायोगिक तौर पर विशेष परिस्थितियों में, फ्लोराइड और क्सीनन आक्साइड प्राप्त किए गए थे, जिसके अस्तित्व का अनुमान सैद्धांतिक लायनस पॉलिंग द्वारा किया गया था।जड़ गैसों का उपयोग कैसे करें
उनके उत्कृष्ट भौतिक-रसायन के लिए धन्यवादअक्रिय गैसों के गुणों को व्यापक रूप से विज्ञान और इंजीनियरिंग में उपयोग किया जाता है। इस प्रकार, तरल बहुत कम तापमान का उत्पादन किया हीलियम, और 4 के अनुपात में हीलियम और ऑक्सीजन के मिश्रण से: 1 एक कृत्रिम सांस लेने वातावरण vodolazov.Poskolku हीलियम के रूप में प्रयोग किया जाता है - हाइड्रोजन के बाद सबसे आसान गैस, वे अक्सर हवाई पोतों, गुब्बारे और जांच भर रहे हैं। इसके उठाने बल लिफ्ट vodoroda.Neon, आर्गन, क्रिप्टन और क्सीनन के 93% के बराबर प्रकाश प्रौद्योगिकी के क्षेत्र में उपयोग किया जाता है - गैस विसर्जन नलियों के उत्पादन। विद्युत प्रवाह नीयन या आर्गन गैस से भरे ट्यूब के माध्यम से पारित हो जाता है जब चमक के लिए शुरू होता है, और इस प्रकाश का रंग सबसे नोबल गैसों की महंगी के रूप में gaza.Argon दबाव पर निर्भर करता है रासायनिक प्रतिक्रियाओं जिसके उत्पाद ऑक्सीजन के साथ बातचीत के दौरान एक अक्रिय माहौल बनाने के लिए प्रयोग किया जाता है।टिप 5: परमाणु कक्षीय क्या है
प्रकृति के किसी भी पदार्थ में सबसे छोटे होते हैंकण, जिन्हें परमाणु कहा जाता है उनके आयाम इतने छोटे होते हैं कि संक्षेप में इन कणों को कभी नहीं देखा गया है, और उनके संरचना और गुणों के आंकड़े विभिन्न प्रकार के जटिल उपकरणों के उपयोग से कई प्रयोगों पर आधारित होते हैं।

परमाणु की संरचना
परमाणु में दो मुख्य भाग होते हैं: कोर और इलेक्ट्रॉन शेल बदले में, नाभिक प्रोटॉन और न्यूट्रॉन का एक संयोजन होता है, जिसे एक साथ न्यूक्लियंस कहा जाता है; नाभिक के इलेक्ट्रॉन शेल में केवल इलेक्ट्रॉन होते हैं नाभिक का एक सकारात्मक आरोप है, लिफ़ाफ़ा नकारात्मक है, और साथ में वे एक विद्युत तटस्थ परमाणु बनाते हैं।कहानी
जैसा कि पहले कहा गया था, परमाणु एक नाभिक होते हैं औरइसके चारों ओर चलने वाले इलेक्ट्रॉनों प्रायः, परमाणुओं के ढांच के चित्र को सरल बनाने के लिए, मानना है कि इलेक्ट्रॉनों को परिपत्र कक्षाओं में घुमाया जाता है, जैसे सूर्य के चारों ओर सौर मंडल के ग्रह यह ज्वलंत मॉडल 1 9 11 में उत्कृष्ट अंग्रेजी भौतिक विज्ञानी अर्नेस्ट रदरफोर्ड द्वारा प्रस्तावित किया गया था। हालांकि, यह प्रयोगात्मक रूप से साबित करना संभव नहीं था, और शब्द "कक्षा" धीरे-धीरे छोड़ दिया गया था बीसवीं शताब्दी के शुरुआती 30-ईज़ में पहले ही यह स्थापित हो गया था कि परमाणु में इलेक्ट्रॉन गति का एक निश्चित प्रक्षेपवक्र नहीं है। ऐसा तब था जब अमेरिकी भौतिक विज्ञानी रॉबर्ट मुलिकेन और जर्मन भौतिक विज्ञानी मैक्स बोर्न के कामों में, एक नया शब्द दिखाई देना शुरू हुआ - कक्षीय - अर्थ की कक्षा में व्यंजन और करीब।इलेक्ट्रॉनिक क्लाउड
इलेक्ट्रॉनिक बादल अंक का पूरा सेट है,जिसमें एक इलेक्ट्रॉन कुछ निश्चित अवधि के लिए यात्रा करता था। इलेक्ट्रॉन बादल के उस क्षेत्र में, जो इलेक्ट्रॉन अधिक बार दिखाई दिया, कक्षीय है। अक्सर, इस अवधि की परिभाषा देकर, यह कहते हैं कि यह परमाणु का स्थान है, जहां इलेक्ट्रॉन की स्थिति सबसे अधिक संभावना है। शब्द "शायद" यहां एक महत्वपूर्ण भूमिका निभाता है सिद्धांत रूप में, एक इलेक्ट्रॉन परमाणु के किसी भी हिस्से में हो सकता है, लेकिन ऑर्बिटल्स के बाहर कहीं इसे खोजने की संभावना बहुत कम है, इसलिए आमतौर पर यह माना जाता है कि कक्षीय का लगभग 9 0% इलेक्ट्रॉन बादल है। ग्राफिक रूप से, कक्षीय एक सतह के रूप में दिखाया गया है जो उस क्षेत्र को चित्रित करता है जहां एक इलेक्ट्रॉन की उपस्थिति सबसे अधिक संभावना है। उदाहरण के लिए, हाइड्रोजन के परमाणु के लिए, कक्षीय में एक गोलाकार आकार होता है।ऑर्बिटल्स के प्रकार
वर्तमान में, वैज्ञानिक पांच प्रकारों को परिभाषित करते हैंकक्षाओं: रों, पी, डी, एफ और जी। उनके आकार क्वांटम रसायन शास्त्र विधियों द्वारा गणना की गई। कक्षाओं के लिए कि क्या उन्हें इलेक्ट्रॉन या नहीं, और प्रत्येक तत्व, अभी ज्ञात के परमाणुओं, आधुनिक रसायन शास्त्र orbitaley.V कक्षीय का एक पूरा सेट है की परवाह किए बिना मौजूद महत्वपूर्ण अवधारणाओं, जो आप रासायनिक बंधन के गठन की प्रक्रिया का पता लगाने के लिए अनुमति देता है में से एक है।काउंसिल 6: वैलेंस क्या है
संयोजक - मुख्य शब्दों में से एक में इस्तेमाल कियारासायनिक संरचना का सिद्धांत यह अवधारणा रासायनिक बॉन्ड्स बनाने के लिए एक परमाणु की क्षमता निर्धारित करता है और मात्रात्मक रूप से उस कनेक्शन की संख्या का प्रतिनिधित्व करता है जिसमें यह भाग लेता है।

अनुदेश
1
संयोजक (लैटिन से वेलेंटाइ - "पावर") एक परमाणु की क्षमता का एक संकेत है जो कि दूसरे परमाणुओं को संलग्न करता है, जिसके साथ एक अणु के भीतर रासायनिक बांड उत्पन्न होते हैं। बॉन्ड की कुल संख्या जिसमें एक परमाणु भाग ले सकता है, वह अपने unpaired इलेक्ट्रॉनों की संख्या के बराबर है। ऐसे बांड को कोवेलेंट बॉन्ड कहा जाता है।
2
Unpaired इलेक्ट्रॉनों मुक्त इलेक्ट्रॉनों रहे हैंपरमाणु के बाहरी कवच, जो एक दूसरे परमाणु के बाहरी इलेक्ट्रॉनों के साथ मिलते हैं प्रत्येक ऐसी जोड़ी को इलेक्ट्रॉन कहा जाता है, और इस तरह के इलेक्ट्रॉनों धैर्य होते हैं। इस से आगे बढ़ने से, वैलेंन्स की परिभाषा इस तरह से हो सकती है: यह इलेक्ट्रॉन जोड़े की संख्या है, जिस पर एक दिया परमाणु अन्य परमाणुओं के लिए बाध्य है।
3
संयोजक परमाणु संरचनात्मक रासायनिक सूत्रों में schematically दर्शाया गया है यदि ऐसी जानकारी की आवश्यकता नहीं है, तो सरलतम फ़ार्मुलों का उपयोग किया जाता है, जिसमें ध्रुवता का संकेत नहीं दिया जाता है।
4
रासायनिक के अधिकतम बलआवधिक प्रणाली के एक समूह के तत्व, एक नियम के रूप में, समूह के क्रम संख्या के बराबर हैं। विभिन्न रासायनिक यौगिकों में, एक तत्व के परमाणुओं को अलग-अलग वैल्यू हो सकता है। जिसके परिणामस्वरूप सहसंयोजक बांड की ध्रुवता को ध्यान में नहीं रखा जाता है, इसलिए वालिस के पास कोई संकेत नहीं है यह शून्य या नकारात्मक नहीं हो सकता।
5
किसी भी रासायनिक तत्व का मात्रात्मक उपाययह मोनोलेलेंट हाइड्रोजन परमाणुओं की संख्या या द्विपदीय ऑक्सीजन परमाणुओं की संख्या पर विचार करने के लिए प्रथागत है। हालांकि, valence के दृढ़ संकल्प में, अन्य तत्वों जिनकी योग्यता अच्छी तरह से जाना जाता है वे भी इस्तेमाल किया जा सकता है
6
कभी कभी valence की अवधारणा के साथ की पहचान की हैशब्द "ऑक्सीकरण की डिग्री", लेकिन यह सच नहीं है, हालांकि कुछ मामलों में ये आंकड़े ही हैं। ऑक्सीकरण की डिग्री - औपचारिक अवधि एक संभव आरोप है, जो परमाणु प्राप्त होता है, तो इलेक्ट्रॉन जोड़े में अपने इलेक्ट्रॉनों एक और अधिक ऋणात्मक परमाणुओं लिए चले गए हैं, जिसका अर्थ है। आरोप के ऑक्सीकरण की डिग्री इकाइयों में व्यक्त किया जाता है, और एक संकेत संयोजकता के विपरीत हो सकता है। के बाद से अकार्बनिक यौगिकों मुश्किल valences न्यायाधीश करने यह शब्द, अकार्बनिक रसायन शास्त्र में बढ़ा दिया गया है। संयोजक यह कार्बनिक रसायन विज्ञान में भी प्रयोग किया जाता है, क्योंकि अधिकांश कार्बनिक यौगिकों में आणविक संरचना होती है।
टिप 7: एक आयनिक बंधन क्या है?
आयनिक बंधन किस्मों में से एक हैरासायनिक बंधन, जो विद्युत रूप से विद्युतीय और विद्युतीय तत्वों के विरोध वाले आयनों के बीच उठता है। आयनों, जो कि अच्छी तरह से जाना जाता है, एक सकारात्मक या नकारात्मक चार्ज वाले कण हैं, जो इलेक्ट्रॉनों के पीछे हटने या लगाव पर परमाणुओं से बनते हैं।
टिप 8: साइटोप्लाज्म क्या है
कोशिका द्रव्य एक बहुत महत्वपूर्ण सेलुलर घटक है इसके अर्द्ध आंतरिक वातावरण स्थित सेल के महत्वपूर्ण कार्यों के लिए जिम्मेदार अंगों में। गतिशीलता cytoplasmic अंगों उन दोनों के बीच बातचीत को बढ़ावा देता है। यह intracellular चयापचय की प्रक्रिया की संभावना देता है।






